QUÍMICA ORGÁNICA
1.1 DESARROLLO DE LA QUÍMICA ORGÁNICA
Hasta que en 1828,Friedich August Kekulé nació en Darmstadt, actual Alemania, en 1829, y falleció en Bonn, en 1896. En 1858 fue profesor de dicha química en Gante (Bélgica), y a partir de 1867 enseñó la misma materia en la Universidad de Bonn. Se le reconoce el establecimiento de las bases de la moderna teoría estructural de la química orgánica. otros como Le Bel, Van`t Hoff y otros, entre 1850 y 1872, han desarrollado el concepto de enlace químico logrando representar las escrituras tridimensionales de las moléculas. En la actualidad se conocen varios millones de compuestos orgánicos diferentes y el ritmo de crecimiento es de mas de cincuenta mil nuevos compuestos por año.
1.2. EL ÁTOMO DE CARBONO
La estructura electrónica del átomo de carbono es 1s², 2s², 2p².
de los seis electrones que posee, solo los cuatro mas externos son los que ingresan desde el punto de vista reactivo.
la unión que se da entre dos átomos de carbono puede ser de tres tipos:
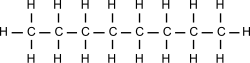
ENLACE SENCILLO
Es la manera más sencilla en la que el carbono comparte sus cuatro electrones. Los enlaces se colocan apuntando a los cuatro vértices de un tetraedro regular, estando el carbono en el baricentro de dicho tetraedro. Se dice que el carbono actúa de manera tetragonal.
El ejemplo más simple lo representa el metano, en el que un átomo de carbono comparte cada uno de sus cuatro electrones exteriores con un átomo de hidrógeno, de modo que tanto el carbono como cada uno de los cuatro hidrógenos completan su última capa electrónica.
A la derecha tienes una simulación en la que puedes girar la molécula arrastrando mientras pulsas el botón izquierdo del ratón, y ampliarla arrastrando mientras pulsas el botón derecho.
Pero el átomo de carbono puede formar enlaces con otros átomos de carbono, originando cadenas que pueden ser larguísimas. El ejemplo más simple de esto es un átomo de carbono que se une a tres hidrógenos y a otro carbono, que a su vez se une a otros tres hidrógenos. En este compuesto, de nombre etano, los dos carbonos actúan de forma tetragonal.
ENLACE DOBLE
El carbono no tiene por qué formar los cuatro enlaces con cuatro átomos distintos. Puede darse el caso de que dos de esos enlaces los forme con un mismo átomo. Hablamos entonces de un enlace doble. Los dos electrones que le quedan al carbono se enlazan con otros dos átomos mediante enlaces simples. En este caso, el enlace doble y los dos simples apuntan a los vértices de un triángulo casi equilátero. Se dice que el carbono actúa de forma trigonal.El ejemplo más simple es el etileno, en el que los dos carbonos comparten dos electrones entre sí y los otros dos que les quedan a cada uno los comparten con dos átomos de hidrógeno. La estructura es trigonal y plana.
También puede el carbono formar el enlace doble con otros elementos, entre ellos el nitrógeno y el oxígeno, como veremos más adelante.
ENLACE TRIPLE
Por último, puede el carbono formar tres enlaces con un mismo átomo, y el cuarto con un átomo distinto. Se habla entonces de un enlace triple. En este caso la molécula es lineal, y decimos que el carbono actúa de forma lineal.El ejemplo más simple de esto es el acetileno, en el que dos carbonos se unen mediante un enlace triple y el electrón que les queda a cada uno lo comparten con un átomo de hidrógeno. Por supuesto, la molécula es lineal.También puede el carbono formar el enlace triple con otros elementos como el nitrógeno, como veremos más adelante.